
СЕПЛАЙФ ®, Все, что вам нужно знать об ионообменной хроматографии
Введение в ионообменную хроматографию:
Ионообменная хроматография — это метод колоночной хроматографии, который использует разницу в электростатической силе между обмениваемыми ионами на ионообменнике и различными ионами, разделенными в окружающей среде, и достигает цели разделения посредством обменного равновесия. Ионообменная хроматография имеет преимущества высокой чувствительности, повторяемости, хорошей селективности и высокой скорости анализа и в настоящее время является одним из наиболее часто используемых методов хроматографии.
В 1848 году Томпсон и др. открыли явление ионного обмена в процессе изучения обмена щелочных веществ в почве. В 1940-х годах появились полистирольные ионообменные смолы со стабильными обменными характеристиками. В 1950-х годах ионообменная хроматография вошла в область биохимии и была применена для анализа аминокислот. В настоящее время ионообменная хроматография по-прежнему является широко используемым методом хроматографии в области биохимии и широко применяется при разделении и очистке различных биохимических веществ, таких как аминокислоты, белки, сахара, вирусы и нуклеотиды.
Процесс ионного обмена:
Реакция между ионообменником и ионами или ионными соединениями в растворе в основном осуществляется путем ионного обмена. Проведенная реакция ионного обмена является обратимой. Предполагая, что RA представляет собой катионообменник, катион A+, диссоциированный в растворе, может вступить в обратимую реакцию обмена с катионом B+ в растворе, и формула реакции имеет вид:
РА + В+ — РБ + А+
Реакция достигает равновесия с чрезвычайно высокой скоростью, а смещение равновесия происходит в соответствии с законом действующих масс.
Селективность ионообменника можно выразить константой равновесия К его реакции:
K锛漑RB][A+]/[RA][B+]
✔Если в реакционном растворе [A+] равно [B+], то K=[RB]/[RA].
✔Если K>1, то есть [RB]>[RA], это означает, что сила связи ионообменника с B+ больше, чем с A+;
✔Если K=1, то есть [RB]=[RA], это означает, что ионообменник имеет одинаковую силу связи с A+ и B+;
✔Если K
✔Значение K является параметром, отражающим силу связывания или селективность ионообменника по отношению к различным ионам, поэтому значение K называется коэффициентом селективности ионообменника по отношению к A+ и B+.
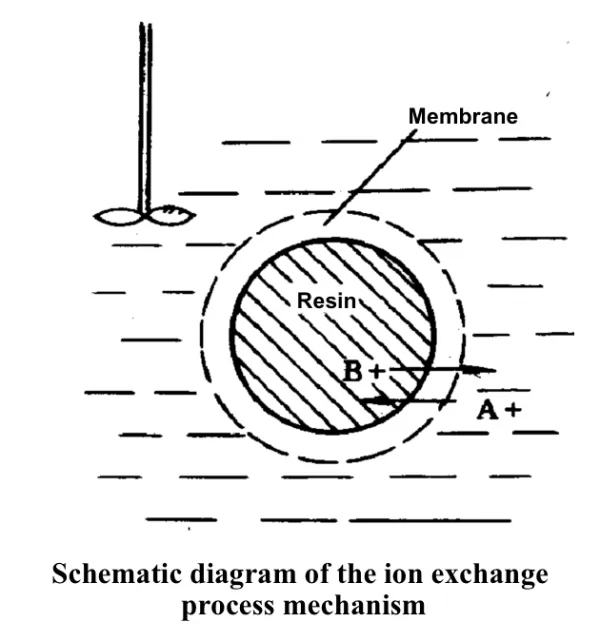
Механизм ионного обмена:
А+ диффундирует из раствора на поверхность смолы.
А+ проникает в активный центр внутри смолы с поверхности смолы.
А+ вступает в реакцию метатезиса с РБ в активном центре.
Десорбированный ион B+ диффундирует из внутренней части смолы к ее поверхности.
Ионы B+ диффундируют с поверхности смолы в раствор.
Контролирующим фактором скорости обмена является скорость диффузии, которая может контролироваться внутренней диффузией или внешней диффузией в различных системах разделения.
Факторы, влияющие на процесс ионного обмена:
✔Размер частиц: чем меньше, тем быстрее
✔Степень сшивания: небольшая степень сшивания, высокая скорость обмена
✔Температура: чем выше, тем быстрее, это связано с увеличением коэффициента диффузии.
✔Валентность ионов: чем выше валентность, тем медленнее скорость диффузии.
✔Размер иона: чем меньше, тем быстрее
✔ Скорость перемешивания: в определенной степени, чем больше, тем быстрее
✔Концентрация раствора: когда скорость обмена контролируется диффузией, чем больше концентрация, тем выше скорость обмена.
Принцип ионного обмена:
Если выбрана катионообменная смола, положительно заряженное вещество обменивается с H+ и связывается со смолой. Если выбрана анионообменная смола, отрицательно заряженное вещество может обмениваться с OH- и связываться со смолой.
Существуют различия в степени прочности соединения веществ на смоле, и компоненты в смеси можно элюировать по одному, выбирая подходящий элюент для достижения цели разделения и очистки.
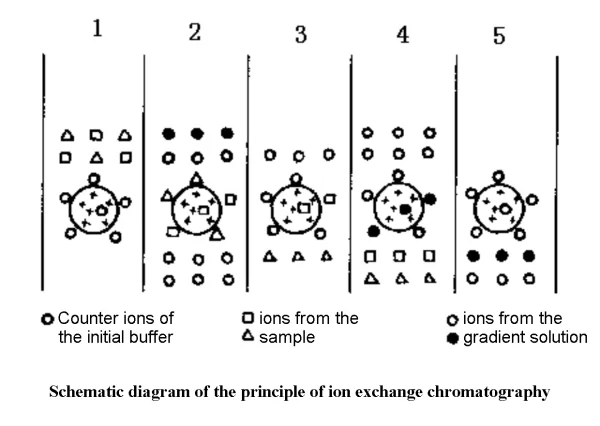
✔1. Стадия уравновешивания: сочетание ионообменника и противоиона
✔2. Стадия адсорбции: обмен образца и противоиона
✔3. Стадия десорбции: градиентный буферный раствор сначала смывает слабо адсорбированные вещества, а затем прочно адсорбированные вещества.
✔4. Этап регенерации: полная промывка исходным балансировочным раствором, который можно использовать повторно.
Смолы для ионообменной хроматографии:
Заряженные группы катионообменников заряжены отрицательно, а противоионы — положительно, что позволяет им вступать в реакции обмена с катионами или положительно заряженными соединениями в растворе.
В зависимости от силы заряженной группы ее можно разделить на три типа: сильнокислотный тип (группа с сульфоновой кислотой, R-SO3H), среднекислотный тип (содержащий фосфорнокислотную группу или фосфористую кислоту, R-PO3H2) и слабокислотный тип (с карбоксильной группой и смолой на основе фенола, R-COOH или R-бензольное кольцо-OH).
В процессе обмена в этих обменниках ионы водорода замещаются посторонними катионами, как показано в следующей формуле:
R锛岰OOH锛婲a+锛漅锛岰OONa锛嬶紜H+
Анионообменник образуется путем введения в матрицу групп четвертичного амина [-N(CH3)3], третичного амина [-N(CH3)2], вторичного амина [-NHCH3] и первичного амина [-NH2].
В зависимости от степени щелочности аминогрупп их можно разделить на три типа: сильноосновные (содержащие четвертичную аминогруппу), слабоосновные (содержащие третичную и вторичную аминогруппу) и среднеосновные (содержащие как сильноосновную, так и слабоосновную группу).
При их обмене с ионами в растворе формула реакции выглядит следующим образом:
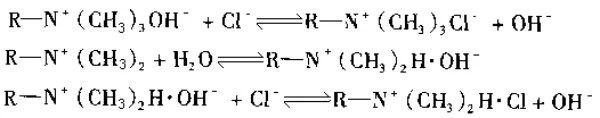
Для получения более подробной информации о конкретных типах смол для ионообменной хроматографии следите за нашей следующей статьей об ионообменной хроматографии.














